Удивительный убийца инфекций – это хлорноватистая кислота. Она встречается как в природе, так и синтезируется в процессе электролиза водного раствора поваренной соли. Другими словами, электрохимический синтез в какой-то степени моделирует имеющие место в природе биохимические реакции с участием ферментов. Общее в этих реакциях одно – хлорноватистая кислота является главным действующим реагентом в реакциях окисления и уничтожения инфекций без нанесения вреда собственным клеткам организма млекопитающих. И в случае биохимических реакций, и в химических реакциях окисления при обеззараживании химическим средством, содержащим хлорноватистую кислоту, последняя является основным ресурсом для генерации метастабильных форм кислорода. В случае реакций с участием солнечных лучей хлорноватистая кислота, взаимодействуя с квантами света, также генерирует метастабильные формы кислорода. В магазине «НАША БЕЛИЗНА» средство «Белизна» получено на установке для электрохимического синтеза «Элехим-рН8-5-01» в виде водного раствора хлорноватистой кислоты и гипохлорита натрия. Среда средства слабощелочная (рН8) и основным активным, действующим компонентом в растворе является хлорноватистая кислота (НСlO). Гипохлорит натрия (NaClO), который также присутствует в электролите, менее активен и эффективен.
Количество хлорноватистой кислоты в растворе «Белизны» зависит как от общей концентрации активных веществ, так и от pH самого раствора:
-
в кислой и нейтральной среде доля Хлорноватистой кислоты (HСlO) составляет 78%, а гипохлорита - 22% (NaClO),
-
в слабощелочной среде при рН= 8, доля хлорноватистой кислоты (HСlO) снижается до 24%, гипохлорита натрия повышается до 76% (NaClO).
-
в щелочной среде 100% присутствует только гипохлорит натрия (NaClO).
Редокс-потенциал E Ox / Red (окислительно-восстановительный потенциал) хлорноватистой кислоты намного выше, чем гипохлорита натрия. Поэтому хлорноватистая кислота обладает более высокой окислительной способностью и активнее вступает в реакции окисления, чем гипохлорит. Наивысшая бактерицидная активность гипохлорита натрия проявляется в нейтральной среде, когда концентрации хлорноватистой кислоты (HClO) и гипохлорита натрия (NaClO) в процессе реакций гидролиза и диссоциации приблизительно равны.
Наличие хлорноватистой кислоты в водных растворах и получающиеся в результате ее диссоциации гипохлорит-анионы (ОСl–) обладают сильными бактерицидными свойствами. При этом выяснилось, что свободная хлорноватистая кислота почти в 300 раз более активна, чем гипохлорит-ионы (ClO-). Объясняется это уникальной способностью HClO проникать в бактерии через их мембраны. Кроме того, хлорноватистая кислота подвержена разложению на свету с образованием в качестве промежуточного вещества атомарного (синглетного) кислорода, который является сильнейшим окислителем.
Реакционноспособный и опасный синглетный кислород может приносить пользу в момент перехода в основное триплетное состояние O2. Синглетный кислород в отличие от обычного молекулярного кислорода легко вступает в химические реакции окисления-восстановления, причем такие реакции могут протекать и в водной среде с выделением не только тепла, но и с излучением световых квантов. Впервые синглетный кислород был выявлен в 1924 г., а затем определен как более активная форма кислорода. Так как кислород вездесущ и эффективно «тушит» электронные возбужденные состояния, то молекула более активного синглетного кислорода, несомненно, играет важную роль в многообразных процессах биосферы от чисто фотофизических в земной атмосфере, до включения в важнейшие фотобиологические реакции живых организмов и растений. В большинстве случаев с синглетным кислородом связаны деструктивные реакции, для нейтрализации которых в живых клетках существуют генетически закрепленные системы защиты, эффективная работа которых обязательна для выживания и нормальной жизнедеятельности организма в целом. Исследованиями установлено, описанный выше процесс аналогичен тому, что происходит естественным образом во всех высших организмах. Так, некоторые клетки человека (нейтрофилы, гепатоциты и др.) синтезируют хлорноватистую кислоту и сопутствующие ей высокоактивные радикалы для борьбы с микроорганизмами и чужеродными субстанциями.
В природе хлорноватистая кислота не является искусственно созданным человеком продуктом, она естественным образом вырабатывается лейкоцитами крови всех млекопитающих. Хлорноватистая кислота играет важную роль в иммунной системе, убивая патогенные микроорганизмы путем окисления. Рассмотрим механизм антибактериальной защиты, созданный природой и функционирующий во внутренней среде животных организмов – от одноклеточных до человека, на протяжении миллионов лет без каких-либо сбоев. В настоящее время неоспоримо доказано, что ведущая роль в бактерицидном действии нейтрофилов принадлежит хлорноватистой кислоте (HClO) вырабатываемой фагоцитирующими клетками. При респираторном инфицировании до 28% от общего количества кислорода, потребляемого нейтрофилами, расходуется на образование HClO. Образование HClO в нейтрофилах происходит из перекиси водорода и хлорид-ионов. Катализатором в этой реакции выступает миелопероксидаза (МПО):
H2O2 + Cl- → [Cat (МПО)] → HClO + OH-
Хлорноватистая кислота диссоциирует в водной среде с образованием гипохлорит-аниона и иона водорода:
HClO ↔ ClO- + Н+
При значениях рН, близких к нейтральному, концентрации HClO и гипохлорит-анионов ClO- приблизительно равны. Понижение рН приводит к сдвигу равновесия этой реакции в сторону увеличения концентрации HClO, увеличение – в сторону повышения концентрации гипохлорит-анионов.
Образование H2O2 и HClO в объеме активной зоны фагоцитоза( процесс поглощения чужеродных частиц клетками) неизбежно сопровождается реакциями спонтанного распада и взаимодействия продуктов этих превращений с образованием активных частиц, аналогичных тем, которые образуются при электролизе воды.
Самопроизвольный распад перекиси водорода в водной среде сопровождается образованием соединений, обладающих очень высокой антимикробной активностью (в скобках приведены соответствующие химические реакции образования активных форм кислорода):
HO2- – анион гидропероксида (H2O2 + OH- → HO2- + H2O)
О22- – пероксид-анион (OH- + HO2- → O22- + H2O)
О2- – супероксид-анион (O22- + H2O2 → O2- + OH- + OH.)
НО2. – радикал пероксида водорода (НO. + H2O2 → H2O + HO2.)
HO2 – супероксид водорода (O2- + H2O → HO2 + OH-)
Одновременно возможным является процесс образования чрезвычайно реакционноспособного синглетного кислорода 1О2: (ClO- + H2O2 → 1О2 + H2O + Cl-). Экспериментально установлено участие в реакциях фагоцитоза молекулярного ион-радикала кислорода О2-, одним из путей образования которого может быть описанный выше.
Известно, что в водной среде в присутствии НСlО и СlO- возможно образование активных свободных радикалов СlO., Сl., НО.:
HClO + ClO- → ClO. + Cl- + НO.
Также весьма вероятным, с позиций современной теории каталитических процессов, представляется образование промежуточного активированного комплекса с участием в качестве катализатора миелопероксидазы. Распад этого комплекса сопровождается образованием О., возвращением катализатора в исходное состояние и подкислением среды:
HClO + ClO- → [HClO ↔ClO- ] → 2Сl- + 2O. + Н+
Активные гипохлорит-радикалы СlO. могут принимать участие в реакциях образования атомарного кислорода (O.) и радикала гидроксила (НO.):
СlO. + СlO- + ОН- → Сl- + 2O. + ОН.
Дальнейшее развитие цепи происходит в процессе формирования атомарного хлора:
OH. + Cl- → Cl. + OH-
Образующиеся радикалы, атомарный кислород принимают участие в уничтожении микроорганизмов, взаимодействуя с биополимерами, способными к окислению, например, в соответствии с реакциями:
RH2 + OH. → RH. + H2O
RH2 + Cl. → RH. + HCl
RH2 + O. → RH. + OH.
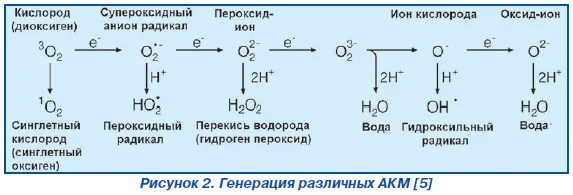
Метастабильная смесь соединений, образующаяся в процессе фагоцитоза, является весьма эффективным средством уничтожения микроорганизмов, поскольку обладает множеством спонтанно реализующихся возможностей изменения (необратимого нарушения) жизненно важных функций биополимеров микроорганизмов на уровне реакций передачи электронов. Метастабильные частицы с различными значениями электрохимического потенциала обладают универсальным спектром действия, т.е. способны оказывать повреждающее действие на все крупные систематические группы микроорганизмов (бактерии, микобактерии, вирусы, грибы, споры), не причиняя вреда клеткам тканей человека и других высших организмов, т.е. соматическим животным клеткам в составе многоклеточной системы.
Учеными ООО «Элехим» разработана технология, которая основывается на фундаментальных знаниях биохимии, физики и химии. Водный раствор хлорноватистой кислоты (HClO) и гипохлорита натрия (NaClO) на сегодняшний день одно из лучших известных средств, проявляющих благодаря гипохлорит-аниону сильную антибактериальную активность. Это средство убивает микроорганизмы очень быстро и при достаточно низких концентрациях, поскольку разложение гипохлорита сопровождается образованием ряда активных частиц (радикалов) и, в частности, синглетного кислорода, обладающего высоким биоцидным действием. Образующиеся при распаде частицы (радикалы) способствуют в уничтожении микроорганизмов (способных к окислению), разрушая окружающую их биопленку, что приводит к «гибели» микроорганизмов.
Магазин «НАША БЕЛИЗНА»
Предлагает продукт, содержащий хлорноватистую кислоту, полученную с помощью процесса, называемого электролизом. Электролиз — это метод, при котором используется постоянный электрический ток для запуска многочисленных электрохимических и химических реакций. Специально разработанные электролизеры могут генерировать раствор, содержащий свободные формы метастабильных веществ путем пропускания электричества через раствор поваренной соли. На аноде образуются окислители хлорноватистая кислота (HOCl) и гипохлорит натрия (NaOCl). Если рН раствора в пределах слабокислого, нейтрального и слабощелочного, то в растворе присутствует хлорноватистая кислота.
Хлорноватистая кислота является мощным окислителем и в сотни раз эффективнее уничтожает патогенные микроорганизмы, чем гипохлорит натрия (щелочной хлорный отбеливатель).
Молекула хлорноватистой кислоты (HOCl) уникальна тем, что она заряжена нейтрально, в отличие от гипохлорит-иона (OCl-), который заряжен отрицательно.
Так почему так важен нейтральный заряд хлорноватистой кислоты?
Дезинфицирующие средства и патогенные микроорганизмы взаимодействуют друг с другом подобно магнитам. Если свести вместе два отрицательно заряженных магнита, они будут отталкиваться друг от друга. Бактерии и гипохлорит (NaOCl, он же отбеливатель) заряжены отрицательно и ведут себя как два отрицательно заряженных магнита, отталкивающихся друг от друга. Хлорноватистая кислота (HOCl) заряжена нейтрально и не отталкивается бактериями. HOCl легко проникает в стенки бактерий и уничтожает их благодаря своему сильному окислительному потенциалу.
Почему важен рН?
Молекулы активных веществ — это молекулы, которые имеет несколько форм. Существует три формы так называемого «активного хлора»: газообразный хлор, хлорноватистая кислота и гипохлорит. При постоянной температуре 25 градусов Цельсия, когда pH ниже 3, свободный хлор покидает раствор в виде газообразного хлора. При значении рН выше 7,5 более 50% составляет гипохорит натрия (NaOCl), содержание гипохлорита увеличивается по мере повышения уровня рН до 14. Между pH 3 и pH 7,5 в растворе будет преобладать хлорноватистая кислота (HOCl). В этом диапазоне раствор крайне нестабилен. А при рН 8 стабильность раствора возрастает и при этом не теряются его антибактериальные свойства.

Хлорноватистая кислота удивительно эффективна при очень низких концентрациях. Хлорноватистая кислота требует очень небольшого количества HOCl (нейтральные и слабощелочные растворы) для эффективного уничтожения бактерий и вирусов и разрушения белков, по сравнению с продуктами на основе отбеливателей с более высоким pH (щелочные растворы). Несмотря на эту выдающуюся способность, она также бережно относится к поверхностям, а когда в состав средства не входят дополнительные ингредиенты, такие как поверхностно-активные вещества или щелочь, растворы HOCl оставляют после себя минимальный остаток. Доказательством этого являются представленные на рынке растворы на основе HOCl в качестве дезинфицирующих средств и средств бытовой химии, в том числе электролизная «Белизна». При электролизе поваренная соль на 50% расходуется на образование хлорноватистой кислоты и гипохлорита. Готовый продукт содержит концентрацию поваренной соли 15 г/л, как в морской воде. Поэтому эти продукты не требуют этапа обильного смывания при использовании на поверхностях.
Для эффективной реализации защиты населения от некачественных и токсичных товаров бытовой химии серии «Белизна» необходима разработка единой научной концепции, базирующейся на фундаментальных законах биологии, современных достижениях физики, химии, других наук, и включающей следующие принципиальные положения:
-
Средства серии «Белизна», полученные с использованием активных форм кислорода (синглетного кислорода, радикалов кислорода и других метастабильных соединений кислорода), должны создать основу для безопасного производства малотоксичных средств, которые при воздействии на бактерии и микроорганизмы не приводят к образованию хлорорганических токсичных соединений.
-
Оценка эффективности антимикробного химического средства должна включать не только спектр его антимикробной активности и время процесса антимикробного действия, но также сведения о способности микроорганизмов вырабатывать резистентность (устойчивость) к данному средству.
-
Главный принцип оценки средств серии «Белизна» по степени безопасности как химических, так и электрохимических средств с антимикробным действием должен заключаться в ответе на вопрос - являются ли действующие вещества или их компоненты ксенобиотиками.
Примечание.
Ксенобиотики (от греч. ξένος — чужой и βίος — жизнь) — чужеродные для организмов или их сообществ химические соединения.
К ксенобиотикам относятся, например, продукты хозяйственной деятельности человека: пестициды, различные препараты бытовой химии, многие лекарственные средства, промышленные загрязнители и другие.
Попадая в окружающую среду, ксенобиотики:
-
влияют на наследственность;
-
вызывают аллергические реакции;
-
могут быть причиной заболеваний и гибели организмов;
-
нарушают естественный ход природных процессов в экосистемах.
Изучение превращений ксенобиотиков в организмах и во внешней среде необходимо для проведения санитарно-гигиенических и природоохранных мероприятий.
В магазине «НАША БЕЛИЗНА» предлагаются средства, которые не является ксенобиотиками.
Поэтому магазин «НАША БЕЛИЗНА» информирует покупателей о степени безопасности средств. Мы получаем и регистрируем все необходимые документы в Российской Федерации, подтверждающие их безопасность.

